継世代影響のメカニズムを探る
─妊娠期ヒ素曝露による発がんを中心に─
Summary
環境化学物質の悪影響が世代を越えて伝わるという、継世代影響が懸念されています。私たちの使命は、環境化学物質によるヒトの健康への悪影響を防ぐために、「なぜ継世代影響がおこるのか」、そのメカニズムを科学的に明らかにすることであると考えています。
ヒ素の健康影響と発がん性
ヒ素による健康被害が世界各国で大きな環境問題となっています。特に、中国やインド、バングラデシュなどアジア諸国では、天然由来の無機ヒ素が地下水に混入し、その水を飲んでいる住民に大きな被害を与えています。ヒ素を連続的に摂取すると、皮膚疾患を特徴とする慢性ヒ素中毒がおこります。さらに、肝障害や心血管系障害や、長い期間を経て各種臓器における発がんが増加することが疫学研究によって明らかにされています。さらに、胎児期などの発達期のヒ素曝露によって、成人後に各種臓器の発がんが増加するという疫学研究の結果も報告されています。
国際がん研究機関も、ヒ素およびヒ素化合物を人に対して発がん性のある物質に分類しています。ヒ素による発がん増加のメカニズムは明らかになっていませんが、近年、ヒ素による発がんにエピジェネティックなメカニズム、特にDNAメチル化変化の関与が示唆されています。
妊娠期のヒ素摂取による子の発がん増加メカニズムの検討
ヒ素による発がん増加メカニズムを検討する動物実験系として、アメリカのWaalkesらのグループは、オスが肝がんを発症しやすいC3Hマウスを用いた実験系を報告しました。これは、妊娠中のマウスに10日間のみ無機ヒ素を含む水を飲ませると、母親の体内で胎児期にヒ素曝露を受けたオスが、成長後74週齢で対照群と比べて肝がんを高率に発症するというものです。そのメカニズムとして、妊娠中の母親への無機ヒ素投与によってひきおこされた、子の肝臓でのある遺伝子のDNAメチル化変化の関与が示唆されました。
私たちはこの実験系を用いて、胎児期のヒ素曝露による成長後の肝がん増加のメカニズムについて研究を行っています。私たちの研究では、胎児期のヒ素曝露によって成長後に肝がんが増加することは確認できましたが、先に述べたようなある遺伝子のDNAメチル化変化は検出されませんでした。妊娠中のヒ素曝露による子の肝がん増加に関与する他のメカニズムがあると考えられたため、私たちは、ゲノム全体のDNAメチル化解析を行いました。その結果、がん遺伝子として知られているFosb遺伝子の遺伝子領域内部のDNAメチル化が、胎児期のヒ素曝露による肝がんで増加することを明らかにしました(図5)。また同時に、Fosb遺伝子の発現も増加することがわかりました(図5)。以上の研究から、Fosb遺伝子のように胎児期のヒ素曝露でDNAメチル化変化がおこり、発現が増加する遺伝子を明らかにすることができました。現在、DNAメチル化変化を介した肝がん増加のメカニズムを解析中です。
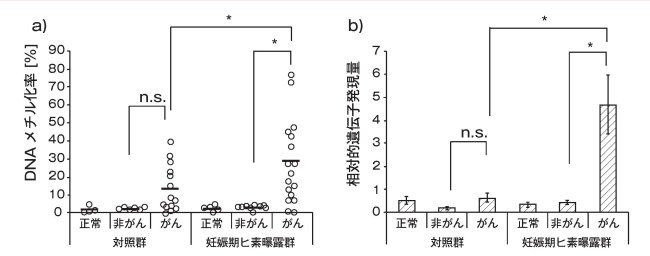
正常な肝臓、がんがある肝臓の非がん部、がんがある肝臓のがん部の各サンプルについてFosb のDNA メチル化率を示しています。○は各サンプルのメチル化率、横棒は平均値、* は有意差あり、n.s. は有意差なし、をあらわしています。妊娠期ヒ素曝露群のがん部のDNA メチル化率は、対照群のがん部と比べて、有意に増加しました。
b)Fosb 遺伝子の発現変化
正常な肝臓、がんがある肝臓の非がん部、がんがある肝臓のがん部にわけて、それぞれの部位でのFosb 遺伝子の発現量を示しています。* は有意差あり、n.s. は有意差なし、をあらわしています。DNA メチル化率に対応して、遺伝子発現量も変化していることがわかります。
発がんには多くの要因が関与し、エピジェネティック修飾変化のみでがんができるわけではありません。ヒ素はバクテリアや細胞株を用いた研究から、DNAに突然変異をひきおこす作用(変異原性)がほとんどないと言われていましたが、私たちのマウスの研究ではヒ素には変異原性があるという結果が出ています。そこで私たちは、C3Hマウスの肝がんの一部ではHa-rasというがん遺伝子が突然変異によって活性化している、という報告に着目しました。そして肝がんのHa-rasの突然変異を調べたところ、胎児期ヒ素曝露を受けたマウスでは、突然変異によって活性化したHa-rasをもつがんが増加していることを明らかにしました。すなわち、Ha-ras変異の増加も、胎児期ヒ素曝露による肝がん増加のメカニズムに関与することが考えられました。
ヒ素の継世代影響
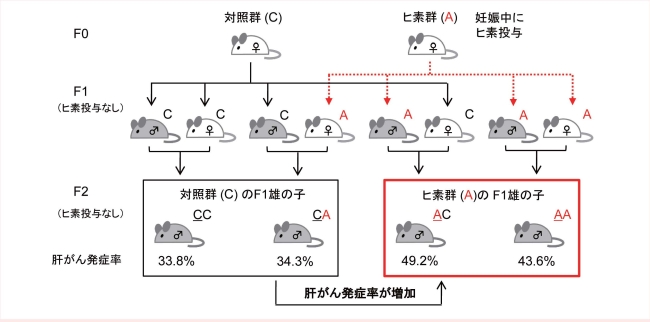
最近私たちは、妊娠中の母親(F0)に無機ヒ素を投与すると、孫の世代(F2)においても、対照群と比べて肝がんの発症率が増加することを見出しました。具体的には、ヒ素を摂取した母親から産まれたオスの子(F1)を父親とする孫世代(F2)のオスが、中年期以降に対照群と比べて肝がんを高率に発症するという結果が観察されました(図6)。この結果は、妊娠期のヒ素の摂取がF2世代まで影響をもつということを世界で初めて明らかにしたものです。
マウスはヒ素に対する耐性が高いことから、上記の実験はヒトが摂取するよりも高い濃度のヒ素を用いて実験しています。今後はメカニズムやさらに低い濃度のヒ素の影響を検討し、妊娠中のヒ素曝露のヒトへの影響の予見や有効な予防法を可能にしたいと考えています。
胎児期の化学物質曝露は、F1の生殖細胞への曝露を介してF2に影響を与えると考えられるため、そのメカニズムについて、私たちはF1の精子に着目して研究を進めています。現在、国内の他機関と共同で、次世代シークエンサーを用い、精子の全ゲノムDNAを対象にしたDNAメチル化解析や突然変異解析を行っているところです。このような研究から、ヒ素の継世代影響のメカニズムを明らかにし、さらに化学物質の悪影響を予防する方法を明らかにすることにつなげていきたいと考えています。
目次
関連研究報告書
-
 2011年9月30日エピジェネティクス作用を包括したトキシコゲノミクスによる環境化学物質の影響評価法開発のための研究(特別研究)
2011年9月30日エピジェネティクス作用を包括したトキシコゲノミクスによる環境化学物質の影響評価法開発のための研究(特別研究)
平成19〜22年度国立環境研究所特別研究報告 SR-94-2011 -
 2006年12月28日化学物質環境リスクに関する調査・研究(終了報告)
2006年12月28日化学物質環境リスクに関する調査・研究(終了報告)
平成13〜17年度国立環境研究所特別研究報告 SR-76-2006 -
 2001年8月31日Proceedings of The 1st International workshop on Health Risks of Arsenic Pollution of Drinking Water in South Asia and China
2001年8月31日Proceedings of The 1st International workshop on Health Risks of Arsenic Pollution of Drinking Water in South Asia and China
(南アジアと中国における飲料水の砒素汚染と健康リスクに関する第1回国際ワークショップ抄録集)国立環境研究所研究報告 R-166-2001